バイクロット®
- バイクロット®配合静注用について
- バイクロット®配合静注用の特性
- バイクロット®配合静注用の作用機序
- バイクロット®配合静注用の用法・用量
- バイクロット®配合静注用の投与間隔
- バイクロット®配合静注用の投与量早見表
- バイクロット®配合静注用の臨床試験成績/有効性(止血効果)/薬物動態/薬力学/安全性(副作用情報)
- バイクロット®配合静注用の保存・携帯
- バイクロット®配合静注用の使用方法
- バイクロット®配合静注用の製造工程
バイクロット®配合静注用について
バイクロット®配合静注用(本剤)は、国内献血由来の血漿を原料として製造した活性化第Ⅶ因子と第X因子を有効成分として1:10のたん白質重量比で含有する「乾燥濃縮人血液凝固第Ⅹ因子加活性化第Ⅶ因子」です。
本剤は、非出血時のインヒビター患者を対象とした第I相試験を行い、次に関節内出血時のインヒビター患者を対象とした第Ⅱ相試験を行いました。
更に、種々の出血時のインヒビター患者を対象とした第Ⅲ相試験を行い、有効性及び安全性を検討しました。
なお、本剤は、2009年2月に希少疾病用医薬品の指定を受けましたが、先天性血友病インヒビターに限定された指定であったため2014年3月に取り下げ、2014年5月に後天性も含む内容で再指定を受けました。
2013年10月に製造販売承認申請を行い、「血液凝固第Ⅷ因子又は第IX因子に対するインヒビターを保有する患者の出血の抑制」を効能又は効果として、2014年7月に承認取得しました。
本剤の定期投与(出血傾向の抑制)を可能にするための適応拡大を目的として、インヒビター保有先天性血友病患者を対象とした第Ⅱ/Ⅲ相試験を行いました。
更に、第Ⅱ/Ⅲ相試験を終了した患者を対象として、本剤の定期投与を長期的に継続する第Ⅲ相試験を行い、有効性及び安全性を確認しました。
2021年9月に製造販売承認事項一部変更承認申請を行い、効能又は効果を「血液凝固第Ⅷ因子又は第IX因子に対するインヒビターを保有する患者の出血傾向の抑制」に変更し、2022年8月に承認取得しました。
後天性血友病については以下の動画にて概要を解説しております。
バイクロット®配合静注用の特性
- 本剤は、世界で初めて開発された「乾燥濃縮人血液凝固第Ⅹ因子加活性化第Ⅶ因子」製剤です。
- 本剤は、希少疾病用医薬品(オーファンドラッグ)に指定されています。また、国産初の国内献血血漿由来のバイパス製剤です。
- 本剤の原材料となる献血者の血液については、HBs抗原、抗HCV抗体、抗HIV-1抗体、抗HIV-2抗体及び抗HTLV-1抗体陰性で、かつALT値でスクリーニングを実施しています。さらに、HBV、HCV及びHIVについては個別の試験血漿で、HAV及びヒトパルボウイルスB19についてはプールした試験血漿で核酸増幅検査(NAT)を実施し、適合した血漿を本剤の製造に使用していますが、当該NATの検出限界以下のウイルスが混入している可能性が常に存在します。
- ウイルス除去・不活化を目的として、有機溶媒/界面活性剤(S/D)処理、ウイルス除去膜ろ過(平均孔径15nm)、65℃・96時間の乾燥加熱工程を導入しています。
- 最終製品は、HIV、HBV、HCV、HAV及びヒトパルボウイルスB19についてNATを実施し、適合を確認しています。
バイクロット®配合静注用の作用機序
- 本剤の投与によるFⅦaの血漿中濃度が上昇し、FⅦaによるFXの活性化を促します。
同時にFⅦaの基質であるFXの血漿中濃度も上昇するため、FⅦaはFXを効率的に活性化します。
本剤の作用メカニズムについて以下の動画でご説明します。
バイクロット®配合静注用の用法・用量
用法・用量
本剤1バイアルを添付の日本薬局方注射用水2.5mLで溶解し、2~6分かけて緩徐に静脈内に注射します。
出血時に投与する場合、活性化人血液凝固第Ⅶ因子として、体重1kg当たり症状に応じて1回60~120μgを投与します。
追加投与は、8時間以上の間隔をあけて行い、初回投与の用量と合わせて、体重1kg当たり180μgを超えないこととします。
定期的に投与する場合、活性化人血液凝固第Ⅶ因子として、体重1kg当たり1回60~120μgを1~2日おきに投与します。
用法・用量に関連する注意
- 本剤1バイアルを添付の日本薬局方注射用水2.5mLで溶解して、活性化人血液凝固第Ⅶ因子として0.6mg/mLの濃度とした後、必要量を投与してください。
- 出血時に投与する場合の注意
2.1初回投与から36時間以内の本剤投与は追加投与として取り扱ってください。
2.2追加投与は1回とし、十分な効果が得られない場合には、血液凝固第Ⅹ因子の蓄積を考慮した上で、他の対処方法も考慮してください。
2.3追加投与の後、次に本剤を投与するまでの間隔は、48時間以上あけてください。 - 定期的に投与する場合の注意
本剤の出血時投与後、定期的な投与を開始する場合は、直近の投与から48時間以上の間隔をおくことを目安とします。
バイクロット®配合静注用の投与間隔
バイクロット®配合静注用をお使いいただく際の投与間隔について以下の動画でご説明します。
出血時投与
定期投与
バイクロット®配合静注用の投与量早見表
バイクロット®配合静注用の臨床試験成績
有効性/安全性
出血時投与(国内第Ⅲ相試験)
12歳以上65歳以下のインヒビターを保有する先天性血友病の男性患者を対象とした多施設共同非盲検非対照試験において、患者14名の21出血エピソードに、総投与量として180μg/kgを超えない範囲で本剤の60μg/kg又は120μg/kgを1回又は2回投与した場合の有効率(著効+有効の割合)は、19/21(90.5%)でした。
また、出血の重症度別の有効率は、軽度の出血が7/7(100%)、中等度の出血が12/13(92.3%)、重度の出血が0/1(0%)でした。
| インヒビター 患者 | 出血数 | 著効 | 有効 | やや有効 | 無効 | 有効率(%) |
|---|---|---|---|---|---|---|
| 合計 (14名) |
21 | 3 | 16 | 0 | 2 | 19/21 (90.5%) |
| 血友病A (8名) |
11 | 1 | 9 | 0 | 1 | 10/11 (90.9%) |
| 血友病B (6名) |
10 | 2 | 7 | 0 | 1 | 9/10 (90.0%) |
副作用は14例(延べ21例)中1例に1件認められ、その内訳は血中カリウム減少4.8%(1/21例)でした。
出典:電子化された添付文書
定期投与(国内第Ⅱ/Ⅲ相試験)
インヒビターを保有する先天性血友病患者を対象とした多施設共同非盲検自己対照試験において、患者11名(男性、血友病B、3~47歳)がそれぞれ現行療法(各被験者が定期投与開始前に行っていたバイパス止血製剤による治療法)を24週間実施後、本剤を24週間定期投与(活性化人血液凝固第VII因子として、1回60~120μg/kgを1~2日おきに投与)しました。主要評価項目であるバイパス止血製剤による治療を要した出血エピソードの年間出血率の成績は下表のとおりでした。
| 現行療法期間 | 定期療法 期間 |
年間出血比率 | ||||
|---|---|---|---|---|---|---|
| 被験者 | 区分 | 現行療法 の種類 |
予備的投与 の薬剤の種類 |
年間出血率 | 年間出血率 | |
| 1 | 成人 | 出血時投与 | - | 27.1 | 0.0 | 0.00 |
| 2 | 成人 | 出血時投与 | - | 21.6 | 6.2 | 0.29 |
| 3 | 成人 | 他剤定期投与 | - | 6.3 | 2.2 | 0.35 |
| 4 | 成人 | 予備的投与 | rFⅦa | 34.4 | 0.0 | 0.00 |
| 5 | 小児 | 予備的投与 | バイクロット® | 17.3 | 10.4 | 0.60 |
| 6 | 小児 | 予備的投与 | バイクロット®, rFⅦa |
15.4 | 38.9 | 2.53 |
| 7 | 小児 | 予備的投与 | バイクロット® | 13.0 | 0.0 | 0.00 |
| 8 | 小児 | 予備的投与 | rFⅦa | 10.8 | 4.3 | 0.40 |
| 9 | 小児 | 予備的投与 | バイクロット® | 10.4 | 2.2 | 0.21 |
| 10 | 成人 | 予備的投与 | バイクロット® | 6.5 | 2.1 | 0.33 |
| 11 | 成人 | 予備的投与 | バイクロット® | 2.3 | 8.5 | 3.77 |
注)予備的投与は、運動等の活動前にバイパス止血製剤を投与することを指す
副作用は11例中1例に1件認められ、その内訳は血中フィブリノゲン減少9.1%(1/11例)でした。
出典:電子化された添付文書
バイクロット®定期投与の臨床試験成績
薬物動態
非出血時のインヒビターを保有する先天性血友病患者に本剤の120μg/kg(4例)を静脈内へ単回投与した際の薬物動態パラメータは、下表のとおりでした。AUC0-t及びCmaxは、本剤の用量に依存して増加し、20~120μg/kg注)の用量範囲で線形性を認めました。
注)本剤の承認された用法及び用量と異なります。
| 測定項目 | AUC0-t (IU・h/mL) |
Cmax(IU/mL) | 半減期(h) | VdSS (mL/kg) |
生体内回収率(%) |
|---|---|---|---|---|---|
| 第Ⅶ因子活性 | 296.33 ± 14.24 |
105.96 ± 10.23 |
2.79 ± 0.61 |
50.91 ± 5.51 |
83.4 ± 7.9 |
| 第X因子活性 | 111.26 ± 11.61 |
4.99 ± 0.46 |
22.66 ± 1.51 |
41.46 ± 4.58 |
120.9 ± 11.4 |
※いずれも、バイクロット120μg/kg投与時の平均値±SD(n=4)
出典:Shirahata A, et al. : Haemophilia 18, 94-101, 2012 改変
薬力学
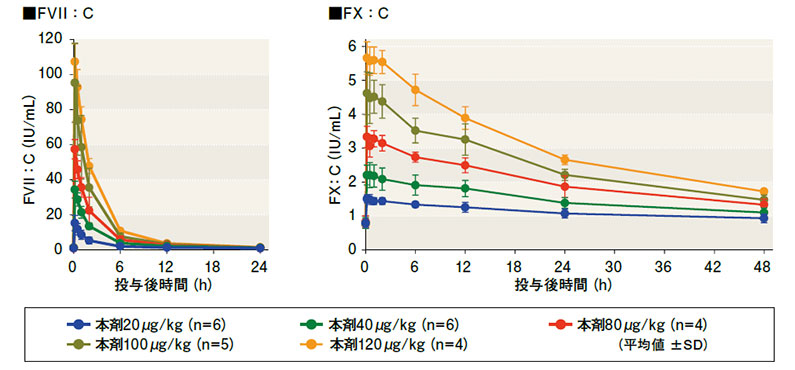
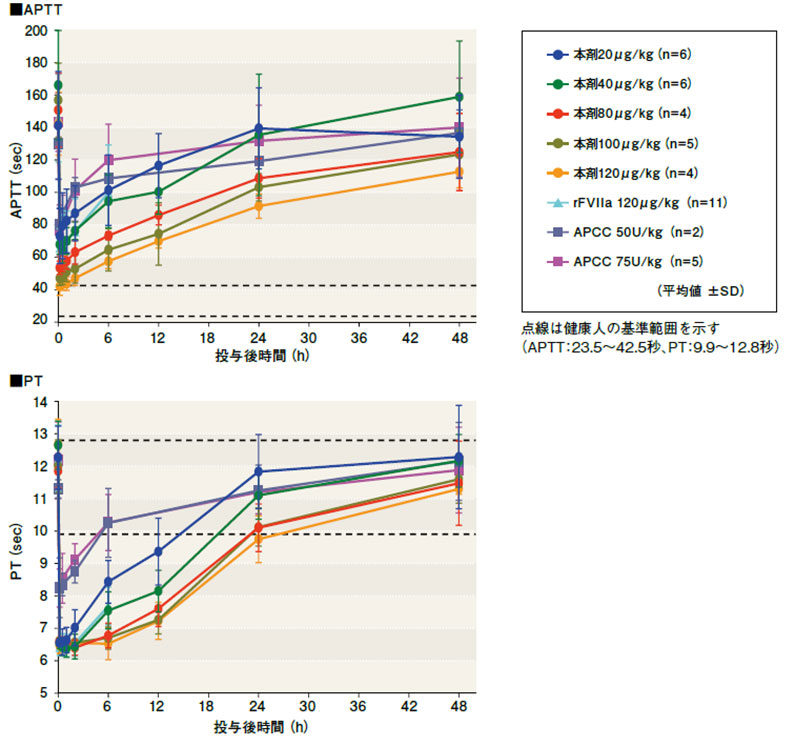
非出血時のインヒビター保有血友病患者(各投与群4~6名)に、本剤の20, 40, 80, 100及び120μg/kg注)を単回投与した際のAPTTとPTの推移は、下図のとおりでした。
APTTは、本剤の用量に依存して補正され、120μg/kgでは、健康人の基準範囲上限(42.5秒)に達しました。PTは、投与直後に測定限界の6秒台まで短縮し、投与6時間以降は本剤の用量が多いほどPTが短縮しました。APTT補正及びPT短縮は、投与24時間後も投与前値まで戻ることはなく、効果が持続しました。
注)本剤の承認された用法及び用量と異なります。
出典:Shirahata A, et al. : Haemophilia,18(1),94-101,2012
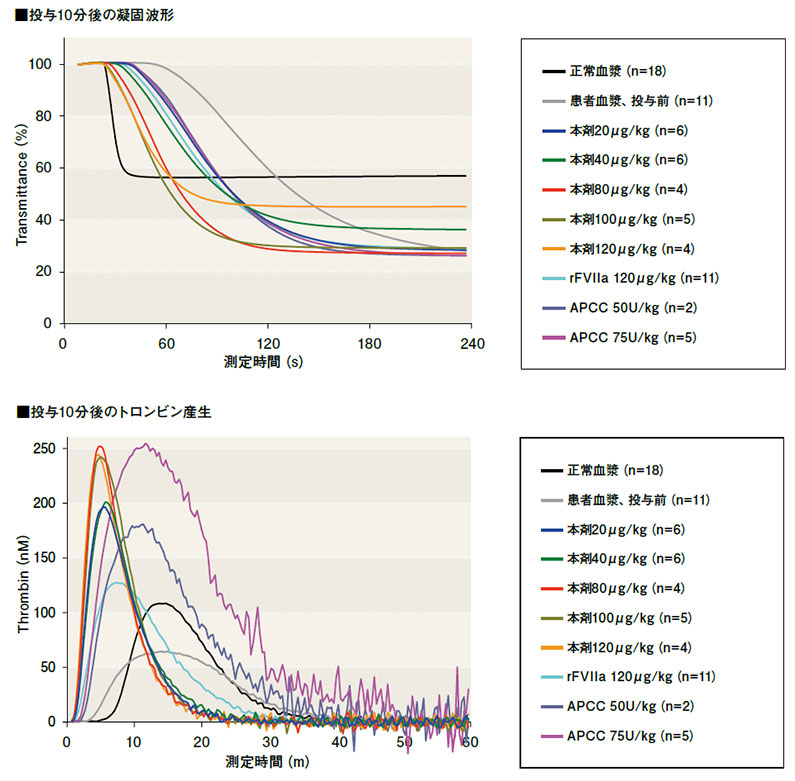
また、凝固波形解析とトロンビン産生試験の結果は、下図のとおりでした。
凝固波形は、投与前に比べ、本剤の用量が多いほど正常血漿の波形に近づきました。トロンビン産生は、投与前や正常血漿に比べ、本剤投与後に凝固開始時間(Lag time)及びピーク到達時間(Time to peak)が短縮し、本剤の用量が多いほどピーク時のトロンビン産生が高くなりました。
出典:Shirahata A, et al. : Haemophilia,18(1),94-101,2012
安全性(副作用情報)
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行ってください。
- 重大な副作用
1.1血栓塞栓症(頻度不明)
動脈血栓塞栓症(心筋梗塞、脳梗塞、腸管虚血症等)、静脈血栓塞栓症(肺塞栓症、血栓性静脈炎、深部静脈血栓症等)が起こることがあります。
1.2DIC(頻度不明)
血小板数及びフィブリノゲン値の減少並びにFDP、D-ダイマーの増加等の凝固系検査異常が認められた場合には適切な処置を行ってください。
1.3ショック、アナフィラキシー(頻度不明) - その他副作用
| 5%以上注) | 1~5%未満注) | |
|---|---|---|
| 循環器 | 血圧上昇 | |
| 消化器 | 腹痛 | |
| 血液 | TAT増加 | |
| その他 | 発熱、頭痛、血中カリウム減少、口腔ヘルペス |
※TAT:トロンビン-アンチトロンビン複合体
注)国内で承認時までに実施された出血時投与の臨床試験の総投与症例から算出
出典:電子化された添付文書
バイクロット®配合静注用の保存・携帯
保存
- 10℃以下で凍結を避けて保存してください。
- 光の影響を防ぐために、薬剤バイアルは外箱に入れた状態で保存してください。
- 患者さんがご家庭で保存する場合、冷蔵庫内で保存することが望ましいですが、室温(30℃以下)で保存することもできます。室温で保存した場合には、使用期限を超えない範囲で6ヵ月以内に使用し、再び冷蔵庫に戻さないように指導してください。
- 製剤は使用する直前に冷蔵庫から取り出し、溶剤を暫く手で温めて常温に戻してから溶解してください。(溶剤が冷たいままだと製剤が溶けにくかったり、投与時に不快感を感じることがあります)
- バイアルにひびが入っていた場合や、使用期間※が過ぎてしまった場合は絶対に使用しないでください。(ご家庭にある場合は、後日、病院に返却してください) ※最終有効年月日は箱やバイアルのラベルに印字されています。
携帯
- 持ち運び時は、車内など直射日光の当たる場所に放置しないでください。
バイクロット®配合静注用の使用方法
バイクロット®配合静注用をお使いいただく際の溶解方法について以下の動画またはPDFでご説明します。
- バイクロット®配合静注用の溶解方法
- ※バイクロット®配合静注用2.5mL/5mL/10mL(室温保存品)も同様の手順で溶解できます。
バイクロット®配合静注用の製造工程
01 原料血漿
HBV、HCV、HAV、HIV、ヒトパルボウイルスB19について核酸増幅検査(NAT)を実施
02 イオン交換クロマトグラフィー
目的のたん白質と不純物を表面電荷の違いで分離
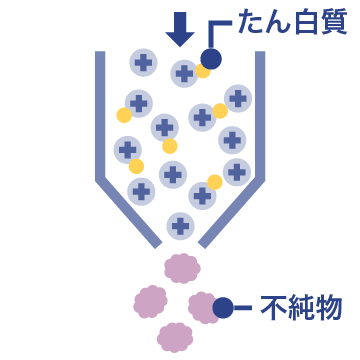
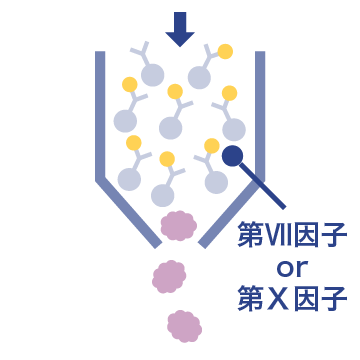
03 イムノアフィニティークロマトグラフィー
第Ⅶ因子または第Ⅹ因子を特異的に精製
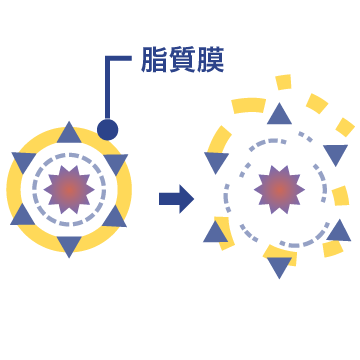
04 S/D処理
有機溶媒(Solvent)と界面活性剤(Detergent)を用いてウイルスのエンベロープ(脂質膜)を破壊
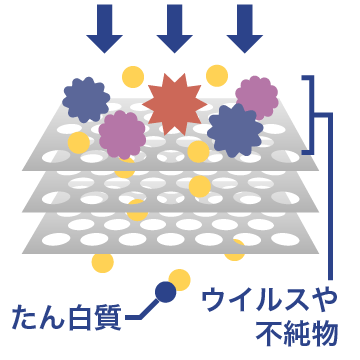
05 ウイルス除去膜ろ過
ウイルスと血漿たん白質の大きさの違いにより、ウイルスを除去
06 乾燥加熱処理
65℃・96時間の熱処理で、ウイルスを不活化
07 最終製品NAT
HBV、HCV、HAV、HIV、ヒトパルボウイルスB19のNATを最終製品で実施
