健康と安全
健康・栄養
貢献するSDGs
医薬品の安定供給
ワクチンの安定供給および研究開発を含めた感染症対策への貢献を継続していきます。
献血の推進
社員の献血への取り組み
当社は血漿分画製剤を提供するメーカーであると同時に、貴重な献血を使用するユーザーでもあります。献血原料の確保に貢献できるよう、年に複数回、日本赤十字社の献血バスを受け入れて、社員が積極的に献血を行っています。また、社員の献血者数を定期的に社内配信することで、献血への意識向上に努めています。

感染症対策
新型インフルエンザワクチン生産体制の整備
国の「新型インフルエンザワクチン開発・生産体制整備事業」の助成金を受け、新型インフルエンザ発生に備えたワクチン生産設備を整備しました。鶏卵を用いない細胞培養法により、国民の約半数に当たる5,700万人分の新型インフルエンザワクチンの生産・供給を担うことになります。
パンデミックに備えたデュアルユース設備の整備
国の「ワクチン生産体制強化のためのバイオ医薬品製造拠点等整備事業」の採択を受け、感染症パンデミック発生に備えたワクチン製造設備を整備します。この整備により、有事の際に国内でワクチンを円滑に生産できる体制を構築することができます。
詳細についてはプレスリリースをご確認ください。
研究開発への積極的な取り組み
新型コロナワクチン
当社は、新型コロナウイルス感染症に対する不活化ワクチンの開発に取り組んでいます。
詳細については以下ページをご確認ください。
デングワクチン
熱帯・亜熱帯地域を中心に世界的に流行しているデングウイルス感染症に対する新規ワクチン(開発コードKD-382)の開発に取り組んでいます。デングウイルスには4つの血清型(1型,2型,3型,及び4型)が存在し、KD-382は、非臨床試験において1回の接種で4つの血清型すべてに対して良好な免疫原性と防御効果を示すことが確認されました。また、フラビウイルス抗体陰性の健康成人を対象として海外で実施した第Ⅰ相臨床試験において、KD-382は良好な忍容性と安全性を示し、更に、1回の接種で4つの血清型すべてに対して良好な中和抗体誘導能(100%陽転)を示しました。
詳細についてはプレスリリースをご確認ください。
世界の子どもたちへワクチンを届ける活動へ参画
不要になった古着を再利用(海外で販売)して途上国の子どもたちへポリオワクチンを届ける外部団体の活動に賛同し、社内で古着を回収しました。これまで回収した古着により、1,810名分のワクチン寄付に繋がっています。
安全・安心
貢献するSDGs
製品における安全・安心の確保
研究開発における倫理的配慮
ヒト由来試料の利用研究における倫理的配慮
ヒト由来試料(組織、細胞、血液、遺伝子など)や情報を利用する研究は、倫理的及び科学的な観点から十分評価した上で実施することが求められています。また、最近ではES細胞やiPS細胞をはじめとしたヒト由来試料を用いた基礎研究、再生医療研究も急速に広がっています。
当社では、生命倫理や安全性に十分に配慮した上で、これらヒト由来試料や情報の利用研究を行う際は、国の指針やガイダンス等※を遵守するとともに、社外委員(医学・医療の専門家、倫理学・法律学の専門家、一般の立場の方)を含む「研究倫理審査委員会」にて承認を得た上で実施しています。
- ※「人を対象とする生命科学・医学系研究に関する倫理指針」など
動物実験における倫理的配慮
動物実験の実施に際しては、動物の愛護・福祉の観点から、動物実験に関する3Rの原則※に基づいて計画を立案し、動物実験委員会の審査および機関の長による承認を必須としております。当社の動物実験実施施設は、外部の機関による評価・認証を受けております。
- ※動物実験に関する3Rの原則
Reduction(使用する動物数の削減)、Replacement(動物を使用しない実験への置き換え)、Refinement(動物の苦痛軽減)

バイオハザードマテリアル・遺伝子組換え生物等の取り扱い
病原微生物などのバイオハザードマテリアルを安全に取り扱うため、「WHO実験室バイオセーフティ指針」等を基にした社内規程を定めています。また、バイオリスクに関する社内委員会では、バイオハザードマテリアルが適正に取り扱われるよう運用ルールを定めるとともに、その取り扱い状況を管理しています。特に、感染症法※1や家畜伝染病予防法などの法令で規定されている病原体等については、社内に専門委員会を設置して、各法令に則った病原体等の取り扱いを適切に管理するとともに、法令に従って必要な手続き(許可・届出)を行っています。
遺伝子組換え生物等についても、カルタヘナ法※2に準拠して適切に取り扱うため、社内規程を定めるとともに、遺伝子組換え生物等の取り扱いに関する社内委員会を設置しています。この社内委員会では、遺伝子組換え生物等を用いた実験がカルタヘナ法で規定された基準に合致しているか事前に確認しています。
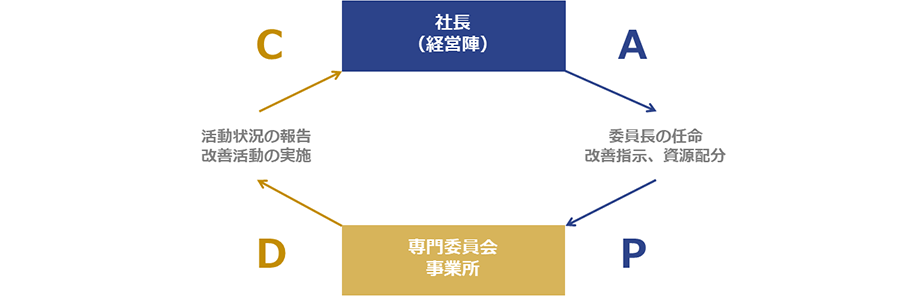
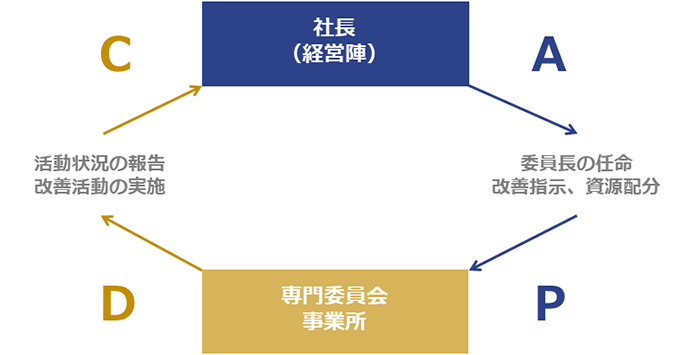
当社では、ガイドラインや法令等に対応した5つの専門委員会を設置し、バイオハザードマテリアル及び遺伝子組換え生物等の管理を行っています。専門委員会は、社長によって任命された委員長が、社内での活動状況を管理・監督しています。
また、委員長及び各事業所の責任者が、それぞれの活動状況について社長を含む経営陣へ報告する会議を定期的に開催しています。この会議では、マネジメントシステムの継続的改善を図るため、必要に応じて経営陣から改善指示や資源配分指示が出されます。
- ※1 感染症法:感染症の予防及び感染症の患者に対する医療に関する法律
- ※2 カルタヘナ法:遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律
人を対象とした医学系研究における倫理的配慮
新しく開発した薬が一般的に使われるようになるには、人を対象とした医学系研究(治験や臨床研究)により、薬としての効果(有効性)と安全性を十分に調べる必要があります。また、人を対象とした医学系研究を行うには、ヘルシンキ宣言※1に則り、生命の尊厳および人権を尊重するとともに、各国・地域の関連法規等※2を遵守して実施しなければなりません。当社では、人を対象とした医学系研究を行う際には、研究に参加される方の人権保護と安全性確保に最大限配慮するとともに、研究の透明性、および科学的妥当性・独立性・信頼性の確保に努めています。研究の倫理性および安全性、科学性については、社内に設置した「研究倫理審査委員会」や治験実施医療機関等の「治験審査委員会」により審査され、当該委員会にて承認を得た上で研究を実施しています。
- ※1 ヘルシンキ宣言:人を対象とする医学研究の倫理的原則
- ※2 「人を対象とする医学系研究に関する倫理指針」など